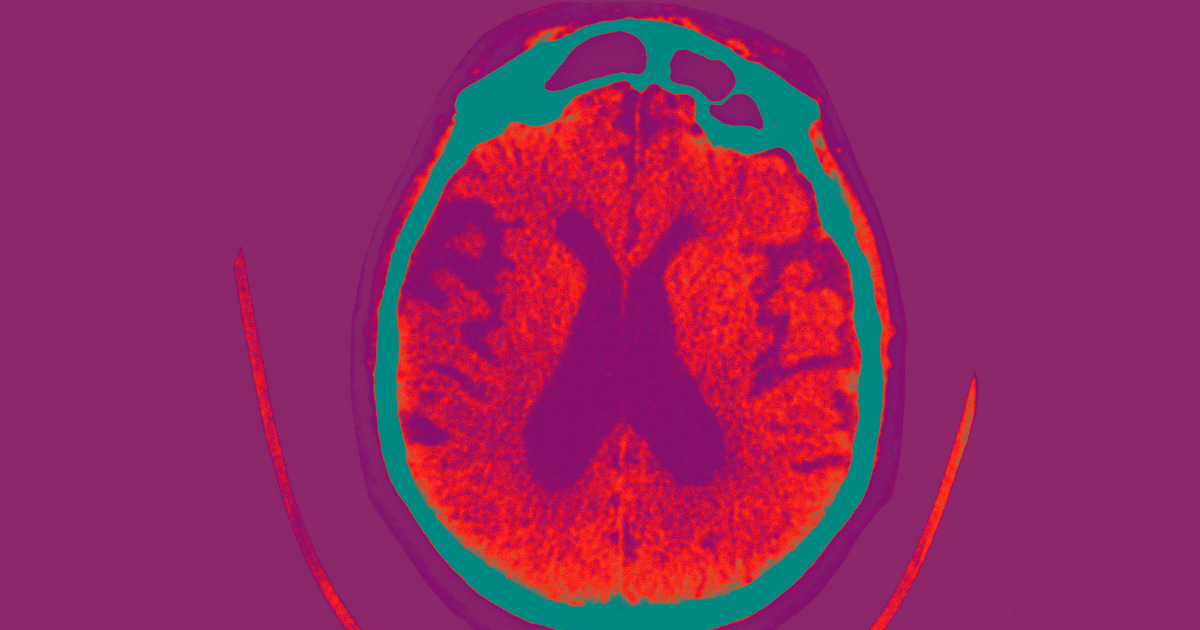
el Administración de alimentos y medicamentos aprobó el viernes un fármaco para el Alzheimer que ha demostrado en ensayos clínicos que ralentiza el deterioro cognitivo en pacientes en las primeras etapas de la enfermedad.
La aprobación ofrece a los pacientes una nueva esperanza después de los repetidos fracasos para encontrar tratamientos efectivos, a pesar de que se han informado efectos secundarios con el nuevo medicamento, dicen los expertos.
El fármaco, lecanemab, que se venderá como Leqembi, es una infusión de anticuerpos monoclonales que se administra cada dos semanas.
La FDA ha aprobado Leqembi para su uso en personas con deterioro cognitivo leve o enfermedad de Alzheimer en etapa temprana.
El fármaco fue aprobado en un curso acelerado, que permite la aprobación temprana de nuevos medicamentos prometedores que «cubren una necesidad médica no cubierta». Al mismo tiempo, las empresas están obligadas a realizar ensayos clínicos adicionales para confirmar los beneficios de sus medicamentos o arriesgarse a retirarlos del mercado.
La agencia dijo que su decisión se basó en un ensayo clínico de fase 3 de 1,795 pacientes, quienes encontraron que el fármaco, desarrollado por los fabricantes de medicamentos Eisai y Biogen, desaceleró el deterioro cognitivo en las personas que lo recibieron en un 27 % después de 18 meses.
La FDA no buscó el consejo de su comité asesor, lo que hizo antes de aprobar de manera controvertida otro medicamento para el Alzheimer desarrollado por Biogen, llamado Aduhelm, en 2021.
Leqembi no es una cura; su objetivo es ralentizar la progresión de la enfermedad eliminando los grupos de beta amiloide, considerados durante mucho tiempo por los científicos como una de las principales causas de la enfermedad, del cerebro.
El beneficio es pequeño, dicen los expertos, pero cualquier cosa que pueda dar a los pacientes más tiempo con la familia y los seres queridos es valiosa.
Se espera que el medicamento dos veces por semana cueste alrededor de $ 25,000 al año para un solo paciente, dijo Ivan Cheung, presidente y director ejecutivo de Eisai en EE. UU., a NBC News. Los Centros de Servicios de Medicare y Medicaid actualmente limitan la cobertura de medicamentos que se dirigen al amiloide en el cerebro, por lo que la adopción del nuevo medicamento puede ser limitada al principio, dijo Cheung.
Se han planteado preocupaciones de seguridad sobre el medicamento. Al menos tres muertos puede estar relacionado con el fármaco después de que los pacientes experimenten inflamación cerebral o hemorragia cerebral.
De acuerdo a a los datos de prueba de fase 3 de la compañía, aproximadamente el 12,6 % de los pacientes que recibieron el fármaco experimentaron inflamación cerebral, en comparación con solo el 1,7 % de los del grupo del placebo. Alrededor del 17 % de los pacientes que recibieron el fármaco sufrieron una hemorragia cerebral, en comparación con el 9 % en el grupo del placebo.
Cheung dijo que la compañía todavía está «segura» de que los beneficios del medicamento superan sus riesgos.
«La enfermedad es devastadora», dijo, «y viene con mucha agitación emocional en todas las familias involucradas».
La enfermedad de Alzheimer es la séptima causa principal de muerte en los Estados Unidos, según Centros de Control y Prevención de Enfermedades. La mayoría de los medicamentos aprobados por la FDA para la enfermedad de Alzheimer están destinados a aliviar los síntomas, no a retrasar la progresión de la enfermedad.
anuncio del viernes viene inmediatamente después de un mordaz informe del Congreso publicado la semana pasada que detalla la aprobación de otro medicamento para el Alzheimer, llamado Aduhelm. El medicamento, desarrollado por Biogen, fue aprobado en 2021 a pesar de que un comité asesor de la FDA descubrió que era poco probable que funcionara. En el informe de la semana pasada, los investigadores dijeron que la agencia no cumplió con sus propios estándares y que su aprobación de Aduhelm estaba «manchada de irregularidades».
En respuesta al informe, Public Citizen, un grupo de defensa, envió una carta el miércoles instando a la FDA posponer su decisión sobre si aprobar o no Leqembi mientras las empresas completan los ensayos clínicos adicionales necesarios para la aprobación total.
Las drogas tienen defensores.
Donna Wilcock, vicedecana de biomedicina de la Universidad de Kentucky, dijo que Leqembi debería aprobarse. Los datos que respaldan la candidatura de Leqembi son «sólidos», dijo, y agregó que los resultados del ensayo son los mejores que «ha visto nunca para un medicamento contra el Alzheimer desde que tenía 25 años».
La Asociación de Alzheimer dijo que, basándose en los resultados de los ensayos clínicos de fase 3 de Eisai y Biogen, la FDA debería aprobar Leqembi para la enfermedad de Alzheimer en etapa temprana.
La organización insta a los Centros de Servicios de Medicare y Medicaid a reconsiderar su decisión sobre nuevos tratamientos para la enfermedad de Alzheimer. El año pasado, en respuesta a los datos deficientes que respaldaban la aprobación de Aduhelm, el CMS dijo que no cubriría los medicamentos para el alzhéimer dirigidos contra el amiloide a menos que los pacientes participaran en una prueba clínica.
Hacer que el medicamento esté más disponible podría significar que más pacientes tengan «muchos más meses para reconocer a sus cónyuges, hijos y nietos», dijo María Carrillo, directora científica de la Asociación de Alzheimer.
En un comunicado publicado después de la aprobación de la FDA el viernes, el CMS sugirió que podría reconsiderar su posición sobre la cobertura de ciertos tratamientos para el Alzheimer.
“CMS está revisando la información disponible y puede reconsiderar su cobertura actual en función de esta revisión”, dijo la agencia.